| I) Généralités sur les canaux K+ | Page d'accueil | Références bibliographiques | |

Les études ont été réalisées sur des canaux K+ clonés exprimés après injection d'ARNm dans l'ovocyte de Xénope et sur des canaux transfectés de façon transitoire dans des lignées cellulaires. L'approche est faite par des techniques électrophysiologiques, c'est à dire double micro-électrodes et patch-clamp. Ces techniques permettent de déterminer les caractéristiques biophysiques des canaux, c'est à dire leur sélectivité, leur dépendance au potentiel, le "gating" des canaux unitaires ou bien leur influence sur le potentiel de membrane. Les propriétés pharmacologiques ont également été analysées avec la recherche de bloqueurs et d'ouvreurs spécifiques. Enfin, la régulation de ces canaux par les messagers intracellulaires tels que l'IP3 (activateur des stocks internes de calcium), le DAG (Di Acyl Glycerol, activateur de protéine kinase C) ou l'AMPc (activateur de protéine kinase A), ainsi que par de nombreux autres effecteurs (Na+, H+, acides gras) a également été étudiée.
Il a été montré que les dérivés de l'oxygène sont impliqués dans de nombreux mécanismes pathologiques notamment des neurodégénérescences et lors de reperfusion après ischémie. Nous avons étudié l'effet de divers systèmes générateurs de dérivés de l'oxygène sur l'activité de canaux clonés, exprimés dans l'ovocyte de xénope (rose de bengal photoactivé et tBHP principalement). Les canaux voltage dépendants de type Shaker (Kv1.3, Kv1.4 et Kv1.5), Shaw (Kv3.4) et le canal à rectification entrante IRK3 sont inhibés par la photoactivation du rose de bengal qui produit principalement de l'oxygène singulet (1DgO2). D'autres canaux tels que Kv1.2 (Shaker), Kv2.1 et Kv2.2 (Shal), Kv4.1 (Shab), IRK1 et ROMK1 (canaux à rectification entrante) sont par contre résistants à ce traitement. Par contre, le tBHP, à l'origine du radical hydroxyl (.OH), inhibe l'inactivation rapide de Kv1.4 et Kv3.4 alors qu'il reste sans effet sur les autres canaux (Duprat et al. 1995a). La modification de l'activité de Kv1.4, Kv1.5 et IRK3, présents dans le cœur et dans le cerveau pourrait expliquer les anomalies électrophysiologiques lors de certaines arrhythmies cardiaques, lors des ischémies cérébrales ou lors de neurodégénérescences.
A partir d'une banque d'ADNc de cerveau de souris quatre clones d'ADNc: IRK3, GIRK2, GIRK3 et GIRK4 ont été clonés dans notre laboratoire (Lesage et al. 1994). Ils sont exprimés principalement dans le cerveau ou pour GIRK4 dans le cœur. Du point de vue des homologies de séquence, IRK3 appartient à la sous famille IRK (Kir2) tandis que GIRK2, 3 et 4 définissent avec GIRK1 une nouvelle sous-famille (Kir3). A la différence d'IRK3, GIRK2 et GIRK4 requièrent, afin d'être ouverts, l'activation d'une protéine G via des récepteurs à sept domaines transmembranaires, comme les récepteurs aux opiacés ou le récepteur muscarinique. Nous avons démontré que les canaux de type GIRK sont fonctionnels sous forme d'hétéropolymères (Duprat et al. 1995b). La formation d'hétéropolymères n'est pas seulement possible, elle est nécessaire, cela n'est pas le cas pour les canaux de type Shaker à rectification sortante ou bien les canaux à rectification entrante de la famille IRK. En effet, l'expression des GIRK ne devient forte et reproductible que si l'on coexprime ensemble deux de ces sous-unités. La nécessité d'une hétéropolymération est telle que le faible courant peu reproductible enregistré lors d'expression d'une seule sous-unité GIRK est dû à la présence d'une sous-unité endogène à l'ovocyte et récemment cloné (Hedin et al. 1996). Le groupe de Clapham a montré que le canal muscarinique du cœur est un polymère composé de GIRK1 et GIRK4 (Krapivinsky et al. 1995). Nos résultats électrophysiologiques et d'hybridation in situ suggèrent que l'hétéropolymère actif dans le cerveau est composé de GIRK1 et de GIRK2 (Lesage et al. 1995). L'équipe du Dr Stoffel a montré que l'absence du canal GIRK2 dans des souris mutées entraîne une forte diminution de l'expression de GIRK1, ce qui permet de supposer une forte interaction entre ces deux sous-unités (Signorini et al. 1997) Nous avons également étudié l'assemblage des canaux IRK en coexprimant IRK1 et IRK3 avec des chimères composées des parties N-terminale, centrale et C-terminale de IRK3 et GIRK2. Cette étude a confirmé que les canaux IRK1 et IRK3 peuvent former un assemblage multimèrique. Les coexpressions ont également montré que les parties centrales de IRK3 et GIRK2 ne donnent pas un canal fonctionnel, qu'un assemblage hétéromultimèrique entre IRK1 et IRK3 est par contre possible et que la partie N-terminale de ces protéines est importante dans l'assemblage. La colocalisation de IRK1 et IRK3 dans certaines zones du cerveau, démontrée par hybridation in-situ, suggère que des hétéromultimères peuvent exister dans les cellules nerveuses (Fink et al. 1996a).
Par recherche dans des banques de données de séquences
nucléiques correspondant au segment P (octapeptide) qui est
présent dans tous les canaux K+ isolés et qui participe au filtre
de sélectivité du canal, plusieurs nouveaux canaux
caractérisés par deux segments P au lieu d'un seul ont
été clonés dans le laboratoire. Une première
séquence présentant les homologies recherchées a
été identifiée dans le génome de la levure.
Après clonage et expression du canal complet, il s'avère qu'il
correspond à un type de canal K+ (que nous avons appelé YORK pour
Yeast Outward Rectifying K channel) radicalement différent des
précédents tant du point de vue structural que fonctionnel (Lesage et
al. 1996a). Les 4 sous-unités formant les canaux de type Shaker (Kv)
ont 6 domaines transmembranaires et un segment P. Les canaux IRK et GIRK sont
composés de 2 domaines transmembranaires et un segment P (Figure 1). La
séquence et le profil d'hydrophobicité du canal YORK
suggère 8 domaines transmembranaires et, fait absolument nouveau, 2
segments P. Cette structure est associée à l'expression de
courants K+ à rectification sortante qui possèdent des
propriétés d'activation hybrides entre celles des courants Shaker
et celles des courants à rectification entrante. En effet, la
rectification sortante de ces canaux n'est pas due à une ouverture
dépendante du potentiel comme pour les Kv, mais plutôt au blocage
du passage des ions dans le sens entrant par une sorte de clapet
intrinsèque à la protéine-canal. Ce mécanisme
ressemble à celui responsable de la rectification des canaux à
rectification entrante avec comme différence majeure le sens de la
rectification et le fait que pour les canaux à rectification entrante,
le clapet n'est pas compris dans la protéine canal mais est
assuré par les ions Mg2+ ou les polyamines intracellulaires. Il n'a pas
encore été trouvé d'équivalent de YORK ni chez les
vertébrés, ni même dans aucune autre espèce animale
et végétale. Toutefois, si ce canal est important pour la
croissance des levures ou des champignons en général, il pourrait
constituer une cible intéressante pour de nouveaux antifongiques.
La
recherche d'homologues présumés de YORK chez le mammifère
a conduit à l'identification d'un transcript abondant dans le cerveau et
le cœur et à un moindre niveau dans de nombreux autres tissus dont
le rein. La séquence et le profil d'hydrophobicité
suggèrent l'existence de 4 domaines transmembranaires et 2 segments P.
L'expression dans l'ovocyte de ce canal, appelé hTWIK1 (pour Tandem of P
domain in a Weak Inwardly rectifying K+ channel), montre qu'il produit des
courants sélectifs pour l'ion K+ (Lesage et
al. 1996b). hTWIK-1 est le premier canal à deux segments P
cloné chez les mammifères, il ne rectifie que faiblement pour les
fortes dépolarisations et reste donc ouvert dans une large plage de
potentiels. Ces canaux pourraient participer à la
perméabilité potassique basale qui impose le potentiel de
membrane de repos dans de nombreux types cellulaires. Si la probabilité
d'ouverture de hTWIK1 est peu dépendante du potentiel, plusieurs
mécanismes peuvent toutefois la modifier, le pH intracellulaire et
l'activité PKC en particulier.
Après hTWIK-1 chez l'homme, le
canal mTWIK-1 a été cloné à partir d'une banque
d'ADNc de souris, en utilisant la séquence de hTWIK-1. La
caractérisation de ce canal dans l'ovocyte de Xénope a permis de
retrouver les mêmes propriétés biophysique que son
homologue humain. L'expression dans l'ovocyte de Xénope, décale
le potentiel de repos de ces cellules vers -80 mV. Le canal présente la
même sensibilité au baryum et à la quinine mais l'effet
bloquant du tedisamil n'a pas été observé. Les toxines
(apamine, charybdotoxine, dendrotoxine), les antiarythmiques et les effecteurs
du courant ATP-sensible sont sans effet sur mTWIK-1 en accord avec les effets
observés sur hTWIK-1. La régulation des deux canaux est
similaire. mTWIK-1 est activé par une perfusion avec du PMA et
insensible à la forskoline et au A23187. Une forte inhibition du courant
est obtenue avec une solution saturée en CO2 pour acidifier le milieu
interne de l'ovocyte, alors qu'une solution externe acide est inactive. La
localisation tissulaire de mTWIK-1 par hybridation in-situ montre une forte
présence dans l'hippocampe, le gyrus dentelé, le cervelet et le
cortex piriforme. L'analyse par Northern blot indique également une
présence dans les poumons et les muscles squelettiques (Lesage et
al. 1997). Une lignée de souris n'exprimant plus mTWIK-1 a
été réalisée au laboratoire et permet
l'étude de la physiologie comparée de TWIK-1. Une étude
comportementale est également prévue sur cette
lignée.
Des séquences du second domaine transmembranaire (M2)
et du pore P2 qui sont très conservés parmi le gène de
TWIK-1 et des gènes identifiés chez Caenorhabditis elegans ont
été utilisées pour cloner chez la souris un nouveau canal,
TREK-1 (TWIK Related K+ Channel). Ce canal a été
caractérisé par expression dans l'ovocyte de Xénope puis
par transfection dans la lignée de mammifère COS. Il
présente la particularité d'être activé par le
sodium externe, ce qui n'a été observé que sur peu de
canaux potassiques. La conductance globale de ce canal est également
augmentée par le potassium externe tout comme les canaux K+ à
rectification entrante. C'est un canal très régulé avec
une inhibition par la voie PKC et par la voie AMPc, les deux voies ayant des
effets additifs. Cette inhibition par la voie AMPc est rare parmi les canaux
potassiques. Le courant TREK-1 est insensible au calcium interne et aux
variations de pH. TREK-1 est insensible à toute la gamme de bloqueurs ou
d'ouvreurs classiquement utilisés sur les courants K+ mais est
inhibé par la quinidine (Fink et
al. 1996c;
Patel et
al. 1998). Le courant unitaire de TREK-1 présente un fort flickering
comme tout les courants 2P actuellement décrits (Fink et
al. 1996c). TREK-1 est fortement activé par l'acide arachidonique et
par un anesthésique général volatile, le chloroforme.
TREK-1 est également mécanosensible, il est ouvert par un
étirement de la membrane. Plusieurs composés amphipatiques
capable de modifier la courbure de la membrane plasmique, les "cup formers"
produisant une incurvation de la membrane et les "crenators" accentuant la
convexité de la membrane, inhibent ou activent respectivement le
courant. TREK-1 est également inhibé lors d'un choc
hyperosmotique dans l'ovocyte de Xénope. ). La plupart des
propriétés de TREK-1 sont identiques à celles du courant
de type S de l'aplysie, (Patel et
al. 1998). Ceci suggère que TREK-1 pourrait être le canal de
type S de mammifère et être impliqué dans des
phénomènes d'inhibition ou de facilitation présynaptique.
La localisation tissulaire de TREK-1 par hybridation in-situ chez la souris
montre une forte présence dans l'hippocampe, le cervelet, le cortex et
le bulbe olfactif. L'analyse par northern blot montre que TREK-1 est
également présent dans le cœur, les poumons et les reins (Lesage et
al. 1997). Une lignée de souris n'exprimant plus TREK-1 est en cours
de réalisation au laboratoire.
En recherchant dans la base de
données GenBank à l'aide des séquences de TWIK-1 et de
TREK-1, un nouveau clone de canal 2P a été identifié, TASK
(TWIK related Acid Sensitive K+ Channel). La nouvelle séquence a
été amplifiée par RT-PCR dans une banque d'ADNc de souris
et introduit dans les vecteurs d'expression pour l'ovocyte et pour les cellules
de mammifères COS. Ce canal est très sélectif au potassium
et présente une dépendance de la conductance au potassium externe
(K½ = 2,1 mM). Les courants TASK suivent l'équation de
Goldman-Hodgkin-Katz modifiée pour prendre en compte la
dépendance de la conductance vis à vis du potassium externe.
Exception faite d'une diminution voltage dépendante par le Cs+ des
courants entrants mesurés à -150 mV en solution externe
hyperpotassique, TASK est insensible à tous les autres effecteurs
testés. Par contre, TASK présente une remarquable
dépendance au pH externe, caractérisée par un pK de 7,3.
L'analyse en Northern Blot montre une présence de TASK dans le cerveau,
les poumons, le pancréas et le placenta. La présence au niveau du
cerveau est confirmée par hybridation in-situ avec un marquage du gyrus
dentelé, du cervelet et du cortex (Duprat et
al. 1997). Le canal TASK-2, cloné à partir d'une banque de
rein humain, présente des propriétés similaires à
TASK et est principalement présent dans les reins, le foie et les
poumons (Reyes et
al. 1998).
Le dernier membre de la famille des canaux 2P, TRAAK (TWIK
Related Arachidonic Acid activated K+ Channel) a été cloné
à partir d'une banque de cerveau de souris. Ce courant est insensible
aux bloqueurs potassiques classiques (TEA, 4-AP, Cs+). La
caractéristique de ce canal est d'être fortement activé par
un acide gras monoinsaturé (acide oléique) et par plusieurs
acides gras polyinsaturés (acide linoléique, acide
linolénique, acide eicosapentaenoique, acide arachidonique, acide
docosahexaenoique) et d'être insensible aux acides gras saturés
(acide palmitique, acide stéarique, acide arachidique), tous à 10
µM. TRAAK est activé par un agent neuroprotecteur, le riluzole
(100 µM) (Fink et
al. 1998).. Le riluzole présente également des
propriétés anti-convulsivantes, sédatives et
anti-ischémique et est utilisé dans le traitement de la
sclérose en plaques (Bensimon
et al. 1994). Le Northern blot de TRAAK démontre qu'il est
uniquement présent au niveau du système nerveux central et
l'hybridation in-situ chez la souris montre une forte expression au niveau de
l'hippocampe, du cortex, de l'habenula, du bulbe olfactif et du cervelet (Fink et
al. 1998). La Figure 2 permet de comparer les relations courant-potentiel
des cinq canaux à 2 segments P clonés chez les mammifères
dans notre laboratoire.
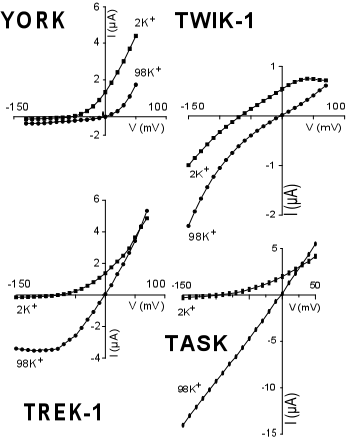
Figure 2
Les récepteurs AMPA (GluRs) sont des canaux ioniques impliqués dans de nombreux phénomènes tels que la plasticité synaptique, le développement neuronal et les neurodégénérescences. Ces récepteurs doivent être acheminés avec précision vers les densités post-synaptiques pour remplir leur rôle. Des travaux récents de l'équipe du Pr Collingridge (Nishimune et al. 1998) et de deux autres équipes (Osten et al. 1998; Song et al. 1998) ont montré une interaction spécifique entre une portion de 10 acides amines du C-terminal des récepteurs GluR2 (AMPA) et la protéine NSF (N-ethylmaleimide-sensitive factor). Cette interaction est surprenante car NSF est une ATPase impliquée dans la fusion membranaire, notamment l'exocytose durant la libération des neurotransmetteurs, c'est a dire un rôle pre-synaptique alors que les récepteurs AMPA sont impliques dans des phénomènes post-synaptiques.
Des enregistrements réalisés sur les soma de cellules pyramidales du CA1 d'hippocampe de rat ont montrés que l'imhibition de l'interaction GluR2-NSF à l'aide d'un peptide (PEP2m) introduit dans la pipette de patch réduit l'amplitude des courants post-synaptiques excitateurs (EPSC) de type AMPA. Nous avons étudié l'effet du blocage de l'interaction NSF-GluR2 sur l'expression d'une forme de plasticité synaptique, la dépression à long terme (LTD). Après avoir atteint l'inhibition maximale des EPSC par PEP2m, un protocole d'induction de la LTD ne peut réduire d'avantage l'amplitude des EPSC dans ces conditions, contrairement aux mêmes expériences en présence d'un peptide inactif. L'expérience inverse ou la LTD est induite par mesures extracellulaires (fEPSP) puis une cellule pyramidale patchée avec une pipette contenant PEP2m montre que ce peptide est inactif sur la voie conditionnée. Ceci montre que les deux mécanismes, LTD et blocage par PEP2m, s'annulent mutuellement. Afin de mieux comprendre le mécanisme d'action, des enregistrements dendritiques ont été réalisés. La diminution des EPSC de type AMPA est associée à une diminution du taux d'échec de l'activité stimulée mais par contre la conductance des récepteurs-canaux AMPA n'est pas modifiée. Ces données suggèrent que les récepteurs ionotropiques de type AMPA subissent un recyclage rapide et que NSF est impliqué dans ce mécanisme. De plus, ce recyclage NSF-dépendant pourrait être un mécanisme important des modifications à long terme de l'activité synaptique au niveau des synapses glutamatergiques (Luthi et al. 1999).
| I) Généralités sur les canaux K+ | Page d'accueil | Références bibliographiques | |