| Sommaire | Page d'accueil | II) Travaux effectués sur les canaux K+ | |

Les canaux potassiques participent à de nombreuses fonctions biologiques et sont notamment responsables du maintien du potentiel transmembranaire, de la transmission de l'influx nerveux et de la rythmogénèse. Ces canaux sont composés de protéines transmembranaires, ils transportent spécifiquement les ions potassium (K+). Le contrôle et la modulation de l'activité de ces canaux ioniques est réalisé par variation du potentiel transmembranaire, par action de messagers intracellulaires tels l'IP3, le DAG ou les protéines G, ainsi que par diverses substances telles que le calcium ou le magnésium. Cette activité peut être couplée à des récepteurs membranaires soit directement, soit via des messagers intracellulaires. Les canaux K+ présentent une grande diversité fonctionnelle et structurale:
Plusieurs familles fonctionnelles de canaux K+ ont été décrites, elles sont principalement basées sur les propriétés biophysique des courants "endogènes" (enregistrés dans les cellules exprimant normalement ces canaux).
Ces canaux facilitent la sortie des ions, ils présentent une rectification sortante. Ceci est caractérisé par une augmentation de la conductance dans le sens sortant (diffusion facilitée) et par un seuil d'activation voltage-dépendant. Ces canaux sont bien caractérisés notamment grâce à leur pharmacologie (Rehm 1991). Ces canaux ont un rôle notamment dans la phase de repolarisation du potentiel d'action et dans la propagation de l'influx nerveux (voir revues de Brown et al. 1990, Christie 1995, Catterall 1995).
Ces canaux favorisent le passage des ions dans le sens entrant au détriment du sens sortant. Ils n'ont pas de seuil d'activation mais leur activité dépend du gradient électrochimique. Au niveau du système nerveux central, plusieurs canaux K+ à rectification entrante ont été décrits: - les canaux couplés à une protéine G (KG) (North 1989) - les canaux ATP-sensible (KATP) (Amoroso et al. 1990; Jonas et al. 1991) - les canaux activés par le sodium interne (KNa+) (Kameyama et al. 1984)
Ces canaux n'ont pas de seuil d'activation et n'obéissent qu'à la loi de l'électrodiffusion. La plupart ne présentent pas ou peu de cinétique d'activation et aucun présente une inactivation. Ces canaux ont été observés dans plusieurs zones du système nerveux central de rat dont l'hippocampe (Guerineau et al. 1994; Shinohara & Kawasaki 1997; Selyanko & Sim 1998; Schweitzer et al. 1998), dans le putamen caudé (Takeshita et al. 1996), le thalamus (Cox et al. 1995), l'hypothalamus (Kim et al. 1995), les motoneurones du tronc cérébral (Bayliss et al. 1994) et l'amygdale basolaterale (Womble & Moises 1992).
Plusieurs courants de fond ont été décrits au niveau du CA1 de l'hippocampe de rat. Ileak est un courant de fond voltage-indépendant et non inactivant, inhibé par 1 mM Ba2+, insensible au 4-AP et au TEA tout comme la plupart des canaux 2P (Selyanko & Sim 1998). Ce courant est par contre inhibé par le Ca2+ interne, cette propriété est peut être apportée par une sous-unité modulatrice des canaux 2P et non encore identifiée. Une autre étude décrit un courant K+ sensible au Ba2+, insensible au Cs+, présentant une courbe courant-potentiel linéaire entre -140 et -40 mV et activé par la somatostatine, probablement via le récepteur sst4 (couplé aux protéines G de type Gq) (Schweitzer et al. 1998). Cet effet est très intéressant car il est probablement du à l'activation d'une phospholipase de type A2 et à la production d'acide arachidonique (Schweitzer et al. 1993). En se basant sur l'absence d'effet de la somatostatine en présence d'inhibiteurs des phospholipases de type A2 et sur la persistance de l'effet en présence d'inhibiteurs de lipoxygenase et de cycloxygénase les auteurs suggèrent que l'effet de l'acide arachidonique est direct sur le canal (Schweitzer et al. 1998).
Le courant de type S a été décrit dans les neurones sensoriels de l'aplysie. C'est un courant de fond, temps-indépendant, insensible au calcium, résistant au Ba2+, au TEA et au 4-AP mais sensible à la quinidine (Shuster & Siegelbaum, 1987; Sigurdson & Morris, 1989; Vandorpe & Morris, 1992; Small & Morris, 1995; Winegar et al., 1996). Ce canal est stimulé par les anesthésiques généraux volatiles comme le chloroforme (Winegar et al., 1996) et par la voie de l'acide arachidonique (Piomelli et al., 1987). Ce canal est également mécano-sensible (Sigurdson & Morris, 1989; Vandorpe & Morris, 1992). Le canal de type S est impliqué dans une forme simple d'apprentissage chez l'aplysie : le réflexe conditionné de rétraction des branchies. Le système nerveux très simple de l'aplysie (24 neurones sensoriels et 6 neurones moteurs) a permis de décrire avec précision les circuits neuronaux impliqués dans ce réflexe et de caractériser deux mécanismes fondamentaux, l'inhibition présynaptique et la facilitation présynaptique. De plus, ce modèle a permis d'analyser un comportement (le retrait des branchies) jusqu'à un niveau subcellulaire, en effet c'est un interneurone facilitateur présentant des récepteurs sérotoninergique qui exprime le courant de type S. Lors du réflexe, ce dernier est inhibé par phosphorylation AMPc-dépendante et permet ainsi des potentiels d'action plus long d'ou une libération accrue de neurotransmetteur. Cet interneurone accroît ainsi la transmission synaptique de l'influx sensoriel (Klein et al., 1982; Siegelbaum et al., 1982). Un mécanisme opposé est déclenché par les interneurones inhibiteurs qui libèrent un neuropeptide, le FMRF-amide, qui ouvre les canaux de type S via la voie de l'acide arachidonique. Ceci aboutit à des potentiels d'action plus courts d'ou une diminution de la transmission synaptique des neurones sensoriels (Belardetti et al., 1987; Buttner et al., 1989). Aucun courant de type S endogène n'a été décrit à ce jour au niveau du système nerveux central de mammifère. Néanmoins, des courants de fond ont été décrits au niveau des interneurones inhibiteurs de l'hippocampe de rat. Plusieurs études ont montré un mécanisme d'inhibition présynaptique impliquant des récepteurs sérotoninergiques (probablement de type 5HT1A, couplé aux protéines de type Gi) sur des interneurones GABAergique du CA1. La sérotonine activerait des conductances sur ces interneurones aboutissant à leur dépolarisation et augmentant ainsi l'inhibition GABAergique sur les cellules pyramidales [Schmitz, 1995 #136 ; Mc Mahon, 1997 #135]. Une autre étude a montré que la cholecystokinine (couplé aux protéines Gq) augmente la libération de GABA des interneurones du CA1 en passant par l'inhibition d'un courant de fond potassique [Miller, 1997 #134]. Ces deux mécanismes aboutissent à un accroissement de l'inhibition des cellules pyramidales du CA1.
Ces canaux semblent régulés par des récepteurs couplés aux protéines Gi et Gq (somatostatine, cholecystokinine, sérotonine, histamine, glutamate). Les courants décrits sont de faible amplitude et sont très souvent obtenu par soustraction des courants totaux avant et après application d'un neurotransmetteur. Peu d'études décrivent les propriétés biophysique des courants de fond de mammifère, notamment les propriétés du courant unitaire, et la pharmacologie de ces canaux est pratiquement inconnue.
Les récents progrès de la biologie moléculaire ont permis d'identifier les structures moléculaires des sous-unités protéiques composant les canaux K+. Parmi les canaux K+ clonés trois familles structurales ont été définies d'après les homologies de séquence, le nombre de segments transmembranaires (STM) et de portion participant à la formation du pore ionique, le segment P (Figure 1). Les familles fonctionnelles correspondent parfaitement avec les familles structurales.
Ce sont les canaux voltage-dépendants (Kv) constitués de sous-unités comportant six domaines transmembranaires (S1 à S6). Le canal fonctionnel est constitué par l'association de quatre de ces sous-unités (homomultimères). Des études sur la relation structure-fonction ont révélé que le quatrième domaine (S4) était responsable de la sensibilité au potentiel (voir revue de Dolly & Parcej 1996).
Cette deuxième famille est composée des canaux à rectification entrante (Kir, inward rectifier). Ils comportent plusieurs sous-familles telles que les canaux à rectification entrante simples, les Kir1 (ROMK1 à 3) et Kir2 (IRK1 à 3) et celle des canaux à rectification entrante sensibles aux protéines G, les Kir3 (GIRK1 à 4). Ces canaux sont constitués de sous-unités comportant deux domaines transmembranaires M1 et M2, et d'un interdomaine H5, ou segment P, qui formerait le pore du canal. Ces canaux sont responsables du maintien du potentiel de membrane. Ils ne laissent passer que des courants entrants car il y a un blocage des courants sortants par le Mg2+ et les polyamines intracellulaires. De façon intéressante, il vient d'être montré qu'une mutation dans la séquence du pore de GIRK2 est responsable, chez la souris, du phénotype weaver. En plus d'un sévère défaut de développement du cervelet, ces souris présentent une dégénerescence précoce et accrue des cellules dopaminergiques de la substance noire comme dans la maladie de Parkinson humaine (Patil et al. 1995). On voit donc un rapprochement intéressant entre les canaux à rectification entrante et la survie neuronale. Les canaux potassium inhibés par l'ATP (KATP) font partie de cette famille. Ils sont constitués par l'assemblage d'un canal à rectification entrante (Kir6.2) et d'une sous-unité récepteur aux sulfonylurées (Inagaki et al. 1995). Ils sont présents dans de nombreux types tissulaires et impliqués dans de nombreuses fonctions. Par exemple, le rôle du KATP des cellules ß du pancréas est très bien caractérisé, il participe à la régulation de la glycémie en intervenant dans la transduction du signal qui suit une hyperglycémie et aboutit à la sécrétion d'insuline. Un rôle neuroprotecteur lors des ischémies a également été décrit. La fonction de ces canaux est de lier le potentiel de membrane au niveau énergétique de la cellule c'est à dire au rapport ATP/ADP (voir Lazdunski 1994 pour revue).
La troisième famille est celle des canaux K+ à 2 segments P dont les premiers représentants ont été récemment clonés (Lesage et al. 1996a, Lesage et al. 1996b, Fink et al. 1996b, Lesage et al. 1997, Duprat et al. 1997, Fink et al. 1998, Reyes et al. 1998). Leur caractéristique structurale est la présence de 2 segments P pour chaque sous-unité protéique, ce qui permet de supposer qu'un canal fonctionnel est composé de l'assemblage de 2 sous-unités au lieu de 4 (Lesage et al. 1996c). Les canaux TRAAK, TASK et TASK-2 suivent la loi de Goldman-Hodgkin-Katz, ils n'ont pas de seuil d'activation, pas de cinétiques d'activation ni d'inactivation, ce sont des canaux de fond. Une des particularités fonctionnelle de ces canaux est l'absence ou le faible effet des bloqueurs potassiques classiques (TEA, Ba2+, Cs+, 4-AP). Le canal TREK-1 (cloné chez la souris) présente des propriétés fonctionnelles très proches du courant de type S (Patel et al., 1998, voir ci-dessous).
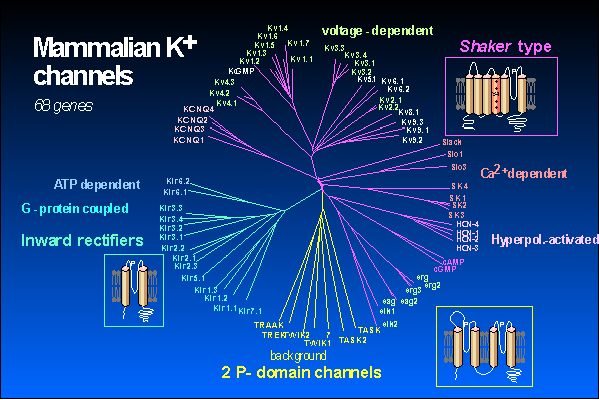
Figure 1
| Sommaire | Page d'accueil | II) Travaux effectués | |