Activités de l'équipe
La membrane des organelles cellulaires est modifiée par différentes protéines. Les manteaux protéiques déforment les membranes pour produire des vésicules de transport. Les golgines, sortes de cordes moléculaires, capturent les vésicules pour limiter leur diffusion. Les transporteurs de lipides ajustent la composition des organelles dans des sites de contact membranaire. Bien que très différents, ces mécanismes sont contrôlés par des petites protéines G, des lipides et par la physicochimie des membranes.
Nous étudions ces mécanismes en utilisant des approches moléculaires, cellulaires et in silico. Grâce à des mesures spécifiques basées sur la fluorescence et la diffusion de la lumière, nous suivons des réactions élémentaires telles que le cycle d'assemblage des manteaux protéiques, l'attachement de liposomes par les golgines et le transfert de lipides dans des sites de contact membranaires. Par microscopie optique ou électronique, nous visualisons ces événements dans des cellules et dans des systèmes reconstitués. La dynamique moléculaire nous permet de décrire les interactions entre protéines et membranes lipidiques à une échelle atomique.
Sujets et principaux résultats
La courbure membranaire est une information cellulaire
Comprendre les membranes lipidiques par des simulations de dynamique moléculaire
Transfert lipidique dans les sites de contact membranaire
Pourquoi les lipides polyinsaturés sont-ils particuliers ?
Propriétés de liaison des hélices amphipatiques
SPHERES : hypertrophie des gouttelettes lipidiques
La courbure membranaire est une information cellulaire En 2003, nous avons montré que le désassemblage du manteau protéique COPI est extrêmement sensible à la courbure de la membrane. Puis, nous avons identifié un senseur de courbure de membrane dans ArfGAP1, un régulateur de COPI. Ce senseur, que nous avons appelé le motif ALPS, est présent dans des protéines de fonctions différentes suggérant que la courbure de la membrane est une information cellulaire. Elle aide à organiser diverses réactions à la surface des organelles. Nous poursuivons ces études en déterminant comment la courbure se combine avec d'autres caractéristiques physico-chimiques des membranes pour contrôler des réactions à la surface d’organelles, par exemple l’attachement des vésicules de transport autour de l'appareil de Golgi.
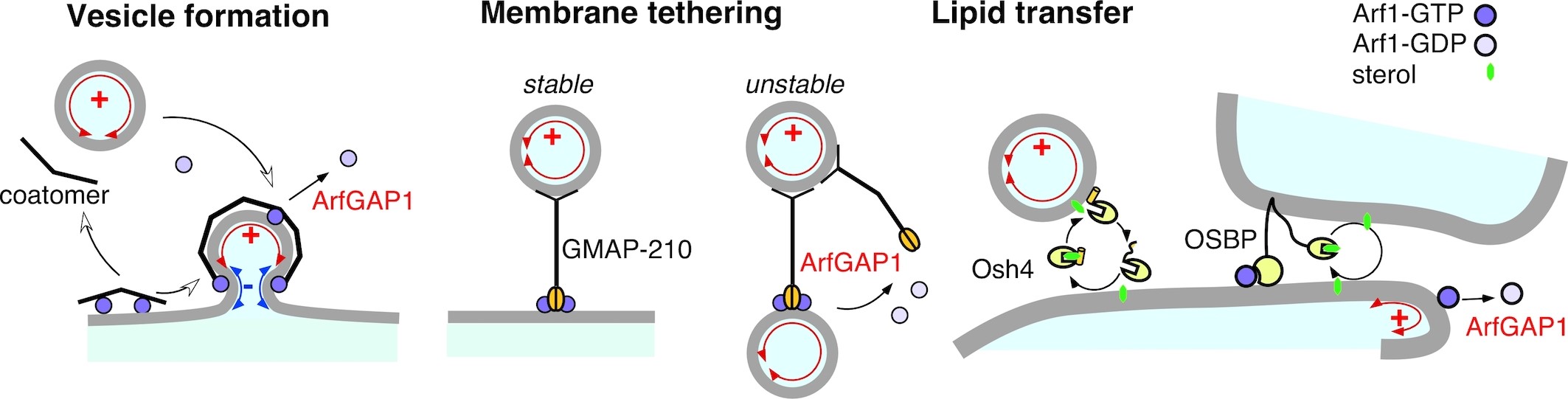 La courbure membranaire permet l’organisation spatiotemporelle de réactions biochimiques
La courbure membranaire permet l’organisation spatiotemporelle de réactions biochimiquesComprendre les membranes lipidiques par des simulations de dynamique moléculaire La nature fluide des membranes lipidiques rend leur étude structurale difficile, si bien que de nombreux paramètres utilisés pour les qualifier, comme les défauts d’agencement lipidique, sont mal connus. Pour contourner cette difficulté, nous effectuons des simulations de dynamique moléculaire. Nous modélisons des membranes de courbure et de composition définies pour prédire leurs propriétés. Ces approches nous ont permis d'expliquer l'effet cumulatif de la courbure membranaire et de l'insaturation des lipides sur la liaison d’hélices amphipatiques. Actuellement, nous étudions l’influence de la composition lipidique sur la réponse mécanique des membranes, en particulier l’effet des lipides polyinsaturés (oméga-6 ou oméga-3) sur la déformation et la fission des membranes.
Caractérisation des défauts d’agencement lipidique d’une membrane simulée par dynamique moléculaire
Transfert lipidique dans les sites de contact membranaire OSBP, une protéine de transfert lipidique, est une machine moléculaire fascinante. D’abord, OSBP transporte un lipide cellulaire clé, le cholestérol. Ensuite, OSBP est impliquée dans des contextes pathologiques tels que des infections virales ou des cancers. Troisièmement, par ses différents domaines OSBP assure deux fonctions : transférer le cholestérol ; attacher le réticulum endoplasmique à l’appareil Golgi. En 2013, nous avons réussi à reconstituer cette double activité. Enfin, une propriété remarquable d'OSBP est l’utilisation de l'énergie métabolique. Nous avons montré qu’OSBP et Osh4, son homologue de levure, échangent le cholestérol contre le phosphoinositide PI4P, puis le PI4P est hydrolysé par une phosphatase du réticulum. Ainsi le PI4P agit comme un ATP lipidique, permettant à OSBP de transférer le cholestérol de façon directionnelle. Nous continuons la dissection du cycle d’OSBP, en particulier le couplage avec les PI4-kinases et les nombreuses interactions protéine-protéine et protéine-membrane impliquées. Plus généralement, nous nous intéressons à l'architecture et à la dynamique moléculaires des sites de contact membranaires ainsi qu’à leur rôle dans le transport des lipides dans des contextes physiopathologiques.
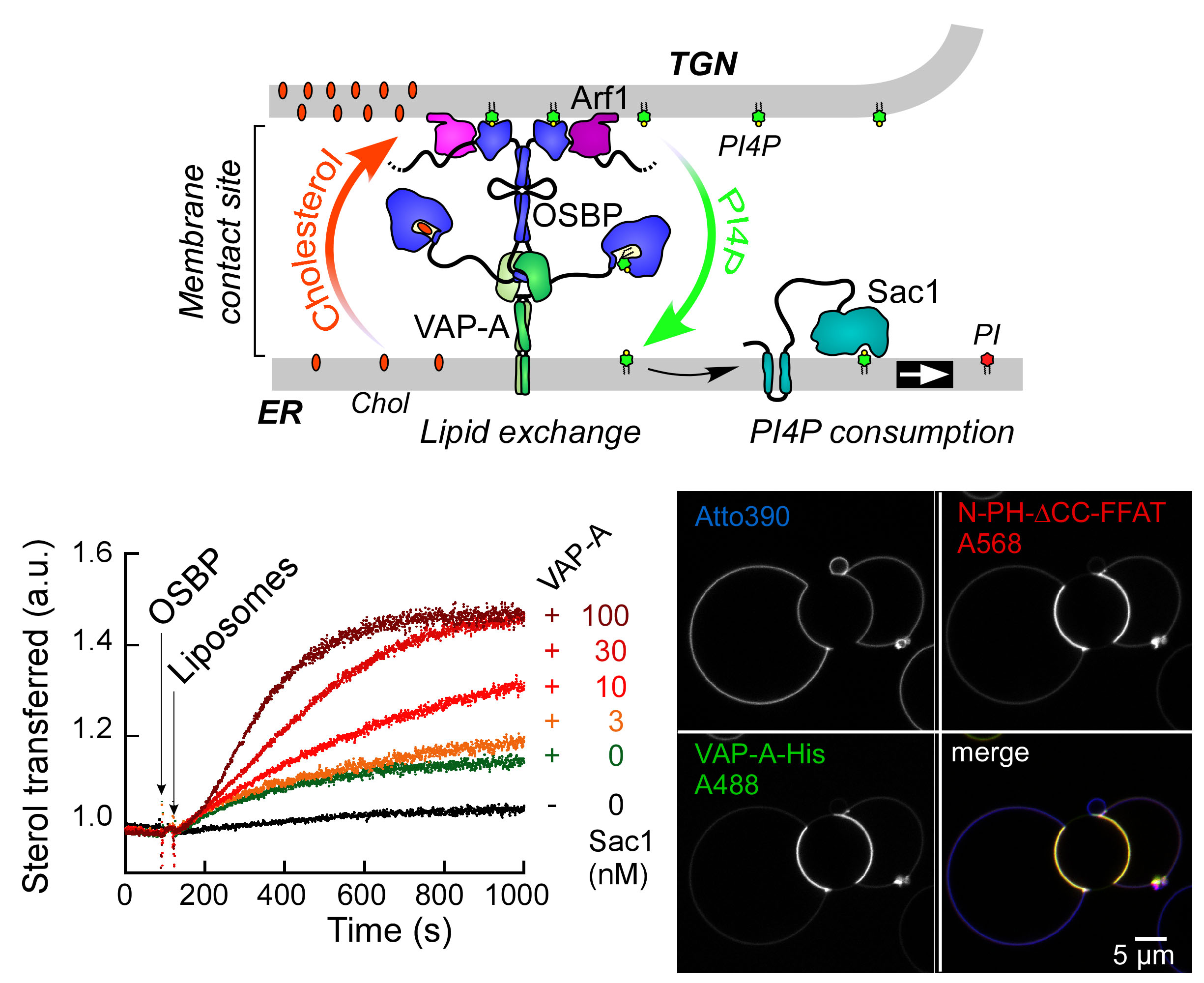 | 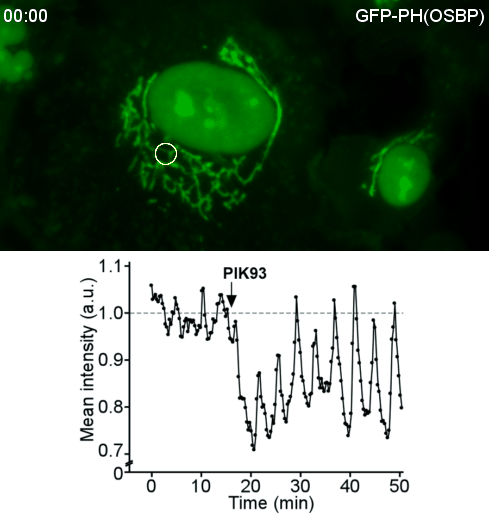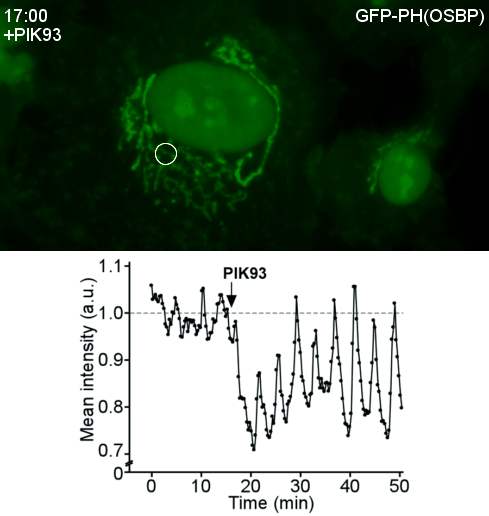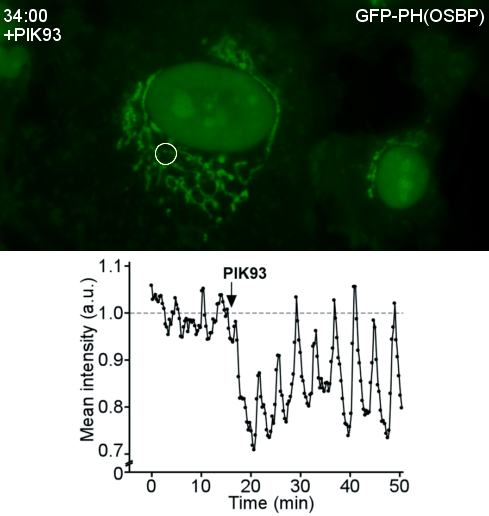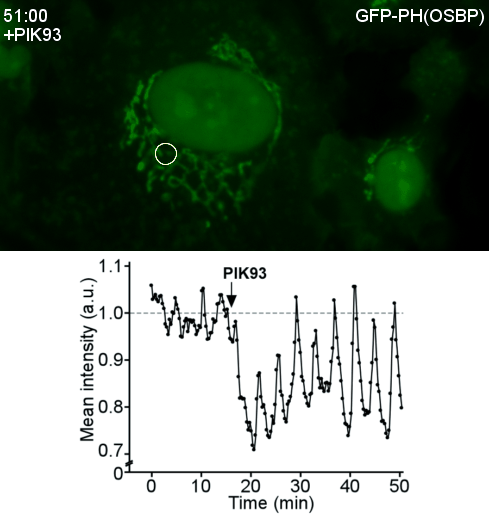 |
| Reconstitution d’un site de contact membranaire fonctionnel par OSBP | Vagues du PI4P au Golgi après perturbation du cycle d’OSBP |
Pourquoi les lipides polyinsaturés sont-ils particuliers ?Les lignées cellulaires classiques permettent d’étudier des fonctions de base ; par exemple, le trafic vésiculaire ou les sites de contact membranaire. Cependant, les lipides de ces cellules ne reflètent pas la diversité trouvée dans des tissus différenciés. Selon le type de cellule ou d'organelle, les membranes présentent des rapports très différents entre lipides saturés, monoinsaturés et polyinsaturés. En ajustant les profils d’insaturation de membranes cellulaires ou de membranes modèles, nous cherchons à comprendre les propriétés apportées par les phospholipides polyinsaturés. Nous avons montré que les lipides contenant une chaîne DHA, l'acide gras le plus polyinsaturé de la famille des oméga-3, rendent les membranes extrêmement flexibles et donc adaptées à l'endocytose rapide. Cette découverte suggère un lien entre l'abondance de lipides polyinsaturés dans les vésicules synaptiques et l'endocytose ultra-rapide des neurones. Nous imaginons que d'autres propriétés cellulaires ou tissulaires (par exemple, la perméabilité cellulaire, la sensibilité aux toxines bactériennes, la progression des maladies neurodégénératives…) pourraient dépendre du profil d’insaturation de leurs membranes, et notamment du rapport entre les lipides oméga-3 et oméga-6.
| 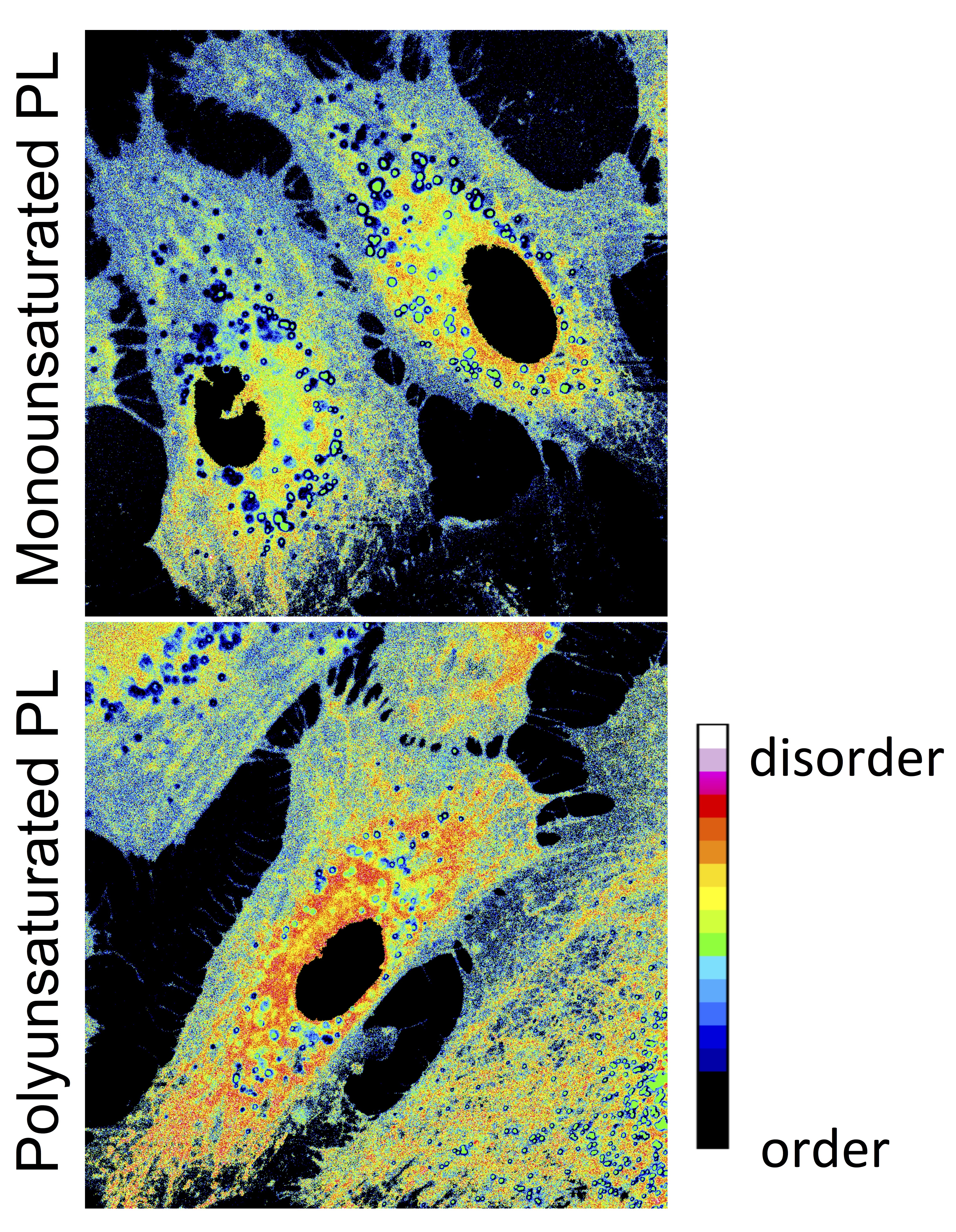 |
| Les membranes biologiques ont des taux d’insaturation lipidique très différents | Polyunsaturated phospholipids change the membrane order |
 Des simulations de dynamique moléculaire par la méthode « Martini gros-grains » montrent que les lipides polyunsaturés facilitent la déformation membranaire
Des simulations de dynamique moléculaire par la méthode « Martini gros-grains » montrent que les lipides polyunsaturés facilitent la déformation membranaire Certaines hélices amphipatiques présentent des propriétés de liaison originales en raison de leur composition particulière en acides aminés. Par exemple, le motif ALPS, qui détecte la courbure de la membrane, est caractérisé par l'abondance de petits résidus non chargés sur sa face polaire. Nous étudions comment la composition en acides aminés d’autres hélices amphipatiques détermine leurs propriétés de liaison. Un exemple récent est la périlipine-4, une hélice géante qui se lie directement à des gouttelettes de triglycérides mais pas à des bicouches lipidiques phospholipidiques in vitro.
 Modèle moléculaire d’un motif ALPS
Modèle moléculaire d’un motif ALPSPour aller plus loin :Bigay et al. 2005, EMBO JDrin et al. 2007, Nat Struct Mol BiolPranke et al. 2011, J Cell BiolVanni et al. 2013, Biophys JVanni et al. 2014, Nat CommunMagdeleine et al. 2016, eLifeCopic et al. 2018, Nat CommunGiménez-Andrés et al. 2018, BiomoleculesSPHERES : hypertrophie des gouttelettes lipidiquesEn 2020, le laboratoire a débuté un nouveau projet financé par l’European Research Council (ERC) Synergy SPHERES : hypertrophie des gouttelettes lipidiques. L'objectif est de comprendre la dynamique et les conséquences moléculaires de l'hypertrophie (élargissement) des adipocytes.
SPHERES est un projet sur 6 ans financé par l’ERC dans le cadre du programme de recherche et d'innovation Horizon 2020 de l'Union Européenne. Il regroupe les équipes de recherche dirigées par : Dominique Langin, Mikael Rydén, et Bruno Antonny. Dans ce projet, le laboratoire établit des techniques pour étudier le tissu adipeux et les cellules dérivées (2D et 3D). L'analyse des lipides est réalisée par chromatographie sur couche mince à haute performance (HP-TLC), TLC-MS et LC-HRMS. La protéomique des gouttelettes lipidiques est prévue en collaboration avec la plateforme omique interne. Une partie importante du projet est la production et la purification de protéines impliquées dans la biologie des gouttelettes lipidiques, provenant de différents organismes, avec un intérêt particulier pour les périlipines. Elles sont actuellement étudiées dans des systèmes de reconstitution in vitro gouttelettes lipidiques-protéines et liposomes-protéines. En outre, des simulations de dynamique moléculaire apporteront de nouvelles informations sur les interactions protéine-protéine et protéine-lipide à la surface des gouttelettes lipidiques.
Pour plus d’informations, veuillez consulter le site officiel du projet ou sur twitter @ERC_SPHERES.
Collaborations récentes
- Alenka Copic, CRBM, Montpellier : gouttelettes lipidiques et protéines amphipatiques
- Claire Hivroz, Institut Curie, Paris ; synapse immunologique et golgines
- Dominique Langin, Université de Toulouse : gouttelette uniloculaire géante des adipocytes
- Emmanuel Lemichez, Institut Pasteur : polyunsaturation des membranes et toxines bactériennes
- Daniel Levy, Institut Curie, Paris : architecture moléculaire des sites de contact membranaires
- Franck Perez, Institut Curie, Paris ; trafic membranaire et golgines
- Fanny Roussi, CNRS, Gif-sur-Yvette : ciblage d’OSBP par des composés naturels
- Mikael Ryden, Institut Karolinska, Suède : gouttelette uniloculaire géante des adipocytes
- Thierry Virolle, Université de Nice Sophia Antipolis : OSBP et le glioblastome
Résumé grand public
Cholestérol et oméga 3 sont des mots familiers. Ces lipides, sont des éléments constitutifs des membranes cellulaires qui définissent la frontière de la cellule ainsi que ses compartiments intracellulaires. Ces membranes sont constamment modifiées physiquement et chimiquement pour permettre des échanges entre différentes régions de la cellule. Nous étudions les mécanismes moléculaires de ces modifications.
Outils Bioinformatiques
 | Le lien suivant donne accès à HeliQuest, un outil bioinformatique permettant l'analyse d’hélices amphipatiques et de rechercher des séquences présentant des propriétés similaires (composition en acides aminés, moment hydrophobe ...). Voir également : Gautier et al. 2008 Bioinformatics https://www.ncbi.nlm.nih.gov/pubmed/18662927
HeliQuest est développé par Romain Gautier et Guillaume Drin. |
 | Le lien suivant donne accès à PackMem, un outil bioinformatique permettant de déterminer la présence de défauts d’agencement lipidique dans des modèles de membranes biologiques obtenus à partir de simulations de dynamique moléculaire. Voir également : Gautier et al. 2018 Biophys J https://www.ncbi.nlm.nih.gov/pubmed/30055754
PackMem est développé par Romain Gautier. |
Photo d'équipe |  |