Equipe du Dr Michel Franco et du Dr Frédéric Luton
Les protéines Arf : transport membranaire, morphologie épithéliale et cancer | Public
expert | Grand
public |
Activités de l'équipe
Schématiquement, la morphologie cellulaire repose sur la membrane plasmique qui forme une enveloppe lipidique à l’intérieur de laquelle le cytosquelette d’actine, un échafaudage moléculaire modulable, structure la forme des cellules. La morphologie cellulaire ainsi que l’arrangement intracellulaire des organelles et des cytosquelettes (actine, microtubules, filaments intermédiaires) sont adaptés au service des multiples fonctions cellulaires telles que le transport vésiculaire, la sécrétion, la phagocytose, l’adhésion, la migration, etc. Les cellules assemblent également des sous-structures membranaires de surface (cil, filopodes, lamellipodes, spicules, CDR, etc) qui leur confèrent des propriétés particulières. Ainsi, l’organisation coordonnée et dynamique de la membrane plasmique et du cytosquelette d’actine est un élément clé du bon fonctionnement des cellules de l’organisme.
La petite protéine G Arf6, ses régulateurs et ses effecteurs sont impliqués dans l’architecture cellulaire et dans de nombreux processus nécessitant un remodelage de la morphologie cellulaire. Ces dernières années nous avons focalisé nos recherches sur leur rôle dans l’organisation du cytosquelette d’actine et le trafic membranaire, la polarité épithéliale et le cancer, et enfin la recherche de drogues anti-cancéreuses.
1) Transport membranaire et cytosquelette d’actine
► Les petites protéines G Arf sont impliquées dans le transport intracellulaire mais leur fonction exacte demeure encore mal définie. Nous avons montré que l’activation du récepteur ß2-adrénergique induit l’activation d’Arf6 par son facteur d’échange EFA6 conduisant à l’inhibition du recyclage du récepteur et son adressage dans la voie de dégradation. Par ailleurs, nous avons mis en évidence une interaction directe entre EFA6 et une protéine à domaine BAR (Bin, Amphiphysin and Rvs), domaine capable de sentir et/ou d’induire la courbure membranaire et de participer ainsi à la formation des vésicules de transport et réguler le trafic vésiculaire. L’ensemble de ces travaux nous permet de définir les bases moléculaires du rôle de la petite protéine G Arf6 et de son activateur EFA6 dans les processus de transport vésiculaire.
Schéma du rôle d’Arf6 dans le transport intracellulaire d’un RCPG
► La réorganisation du cytosquelette d’actine est nécessaire au processus de transport intracellulaire mais également à l’accomplissement de nombreuses fonctions cellulaires telles que la mise en place de la polarité épithéliale et la migration cellulaire. Dans les cellules épithéliales, nous avons montré que EFA6/Arf6 régulent l'assemblage et la maintenance des jonctions serrées. Par ailleurs, EFA6 et son partenaire l’alpha-actinine jouent un rôle essentiel dans la formation et l’extension du lumen. Ces protéines agissent en régulant le transport de membranes lipidiques et la contractilité du système acto-myosine présent au pôle apical.
EFA6/Arf6 régulent les jonctions serrées, la luminogenèse et la polarité épithéliale
► L’assemblage du cil primaire ou ciliogénèse est un autre exemple de polarisation cellulaire. Nous avons montré le rôle essentiel du couple EFA6A/Arf6 dans les étapes précoces de l’assemblage du cil et tout particulièrement dans les processus de fusion des premières vésicules membranaires qui viennent s’arrimer au centriole mère afin de donner naissance à la vésicule ciliaire puis au cil.
Schéma du rôle d'EFA6 dans l'assemblage du cil primaire
► La protéine EFA6 est capable d’induire une forte réorganisation du cytosquelette d’actine. Nous avons montré que son extrémité C-terminale interagit directement avec les filaments d’actine inhibant la polymérisation aux bouts barbés et induisant la formation de câbles d’actine.
Schéma du rôle du domaine C-terminal d'EFA6
dans la formation d'extensions de la membrane plasmique
► En collaboration avec l’équipe du Dr. Tâm Mignot (Institut de Microbiologie de la Méditerranée, Marseille) nous avons démontré que le changement rapide de polarité cellulaire lors de la mobilité chez la bactérie Myxoccocus xanthus est régulé par une petite protéine G homologue à la famille Arf, la protéine MglA et sa GAP (GTPase Activating Protein) la protéine MglB. A l’instar des eucaryotes, cette motilité requiert une connexion entre cette petite protéine G MglA et MreB, une protéine analogue à l’actine eucaryote.
Schéma du rôle de la petite protéine G MglA
dans la mobilité de la bactérie M. xanthus
Macia et al. 2012, J. Cell Sci.Boulakirba et al. 2014, Proc. Natl. Acad. Sci. USAMilanini et al. 2018, J. Cell Sci.Partisani et al. 2021, J. Cell Sci.Macia et al. 2019, Sci. ReportsZhang et al. 2010, PLOS Biol.Treuner-Lange et al. 2015, J. Cell Biol.Su et al. 2010, Nat. Cell Biol. 2) Polarité épithéliale et cancer
Les tissus épithéliaux tapissent la face interne des organes. Ils sont formés de cellules polarisées présentant un domaine apical ouvert sur l’extérieur (lumen) et un domaine basal orienté vers le tissu conjonctif sous-jacent. La cohésion et l’imperméabilité des tissus épithéliaux sont assurées respectivement par les jonctions adhérentes et les jonctions serrées.
Comme indiqué ci-dessus, nous avons trouvé qu’EFA6 et Arf6 participent à l’homéostasie des tissus épithéliaux en agissant sur les jonctions serrées, l’anneau d’acto-myosine apical et le lumen. Nous avons montré que le niveau d’expression d’EFA6 est finement régulé par le système ubiquitine-protéasome au cours de la morphogenèse épithéliale et régule la transition épithélio-mésenchymateuse (TEM). En l’absence d’EFA6, les tissus épithéliaux fragilisés sont prédisposés à perdre leur polarité apico-basale et à s’engager dans la TEM. Enfin, dans un modèle de cancer du sein, nous avons montré qu’EFA6B est un gène haplo-insuffisant dont la perte d’expression facilite in vivo la progression tumorale du stade in situ au stade invasif.
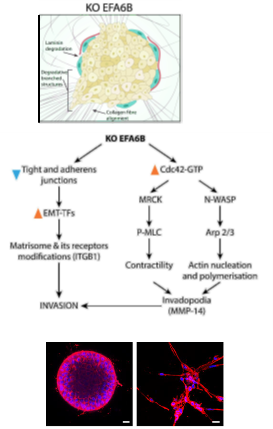
EFA6/Arf6 régulent la TEM et l'invasion collective
3) Drogues anti-cancéreuses
Dans le laboratoire, nous développons deux types de drogues anti-cancéreuses : des inhibiteurs de l’invasion tumorale dépendante d’Arf6 et des inhibiteurs de Patched qui fonctionne comme une pompe à efflux conférant une résistance aux chimiothérapies.
► Inhibition de l’activation d’Arf6. Nous avons démontré récemment qu’une tétracycline, la chlortétracycline (CTC) bien connue pour ses propriétés antibiotiques par blocage de la synthèse protéique, est capable de se lier à Arf6 et d’inhiber son activation. Ainsi nous montrons que la CTC est capable d’inhiber de façon non compétitive l’activation d’Arf6 in vitro qu’elle soit catalysée par un facteur d’échange ou spontanée. CTC est également capable d’inhiber la migration cellulaire dépendante d’Arf6 et stimulée par EGF ainsi que les propriétés d’invasion collective en culture 3D en gel de collagène de cellules cancéreuses mammaires.
Modélisation de la structure 3D du complexe Arf6GDP-CTC
► Rôle du récepteur Patched dans la résistance des cellules cancéreuses à la chimiothérapie. La résistance des cancers aux chimiothérapies induit des récidives tumorales, des métastases, des échecs thérapeutiques et trop souvent le décès des patients. Nous avons montré que le récepteur de la voie Hedgehog Patched (Ptch1), qui est exprimé dans de nombreux cancers métastatiques, est une pompe à efflux de médicaments et contribue à la résistance des cellules cancéreuses à la chimiothérapie. Nous avons identifié des inhibiteurs de l’activité d’efflux de Patched, et montré que ces molécules augmentent l’efficacité de plusieurs médicaments chimiothérapeutiques contre des cellules issues de plusieurs types de cancers dont le mélanome in vitro et in vivo, et le cancer du sein in vitro. Nos résultats suggèrent que l’utilisation d’un inhibiteur de l’activité d’efflux de Patched comme adjuvant aux chimiothérapies pourrait permettre d’augmenter l’efficacité des traitements et la survie des patients atteints de cancers exprimant Patched.
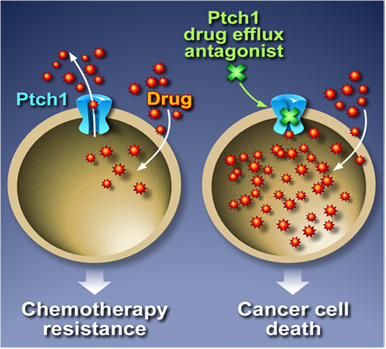
Représentation schématique de l'effet des inhibiteurs de l'activité d'efflux de Patched
Macia et al. 2021, Molecules
Fiorini & Mus-Veteau 2016, Methods Mol. Biol.
Hasanovic et al. 2018 Int. J. Cancer
Hasanovic et al. 2018 Cells
Signetti et al. 2020 Cancers
Hasanovic et al. 2020 Biomedicines
Durand et al. 2021 Molecules
Kovachka et al. 2021 Phys. Chem. Chem. Phys.
Kovachka et al. 2022 Eur. J. Med. Chem.
Feliz Morel et al. 2022 Pharmaceutics
L'équipe est membre de :
 |  | L'équipe est membre du Laboratoire d'Excellence "SignaLife" regroupant 6 laboratoires niçois qui ont pour but d'étudier les voies de signalisation chez les animaux et les plantes |
Financements