Equipe du Dr Guillaume Drin
Transport de lipides : mécanismes moléculaires et rôle dans la pathogenèse | Public
expert | Grand
public |
Activités de l'équipe
Les lipides, un ensemble regroupant plus de mille sous-espèces moléculaires, sont répartis précisément dans les cellules eucaryotes. Chaque type d’organelle possède une composition lipidique spécifique, et de ce fait, a des caractéristiques physiques et une identité propre, ce qui est essentiel pour la localisation et la fonction de nombreuses protéines. En conséquence, le décryptage des mécanismes qui sous-tendent cette homéostasie lipidique est indispensable à la compréhension de nombreuses fonctions cellulaires et physiologiques. Comme toute altération de cette homéostasie peut conduire à des états physiopathologiques, ceci permet également de comprendre les bases moléculaires de certaines maladies communes ou rares
Depuis plusieurs années, nous travaillons sur les mécanismes moléculaires du transport lipidique, l'un des processus majeurs de l'homéostasie lipidique cellulaire. Plus précisément, nous disséquons le mode d'action de protéines appelées « Lipid Transport Proteins » (LTP), qui aident les lipides, hydrophobes, à franchir le « mur d’eau » entre les organelles. Nous avons découvert que les protéines ORP/Osh sont des échangeurs lipidiques qui utilisent le métabolisme d'un lipide singulier, le PI4P, pour transporter du stérol ou de la phosphatidylsérine (PS) du RE vers le trans-Golgi ou la membrane plasmique. Ce nouveau mécanisme explique comment certains lipides sont acheminés de manière unidirectionnelle entre organelles et sont ainsi repartis selon des gradients de concentration dans la cellule. Notre objectif actuel est d'étendre notre travail sur ces protéines mais aussi sur d'autres familles de LTP pour étendre nos connaissances sur le transport lipidique dans des contextes cellulaires normaux mais également pathologiques.
Notre équipe a trois axes de recherche principaux.
1 - Une analyse complète de l'échange PS/PI4P
La phosphatidylsérine (PS) est le principal lipide anionique des eucaryotes, représentant ~10% des lipides. Ce lipide est distribué avec précision entre et à travers les membranes cellulaires. Les niveaux de PS augmentent jusqu' à 5 fois entre le réticulum endoplasmique, son site de synthèse, et la membrane plasmique où les molécules de PS apportent des charges négatives et jouent un rôle critique dans le recrutement et l'activation de certaines protéines de signalisation. On ignorait comment la phosphatidylsérine s'accumulait dans la membrane plasmique jusqu' à la découverte récente que des protéines de la famille ORP/Osh appelées Osh6p et Osh7p transportent ce lipide dans la levure S.cerevisiae. Récemment, nous avons dévoilé que Osh6p et Osh7p peuvent lier alternativement du PS et du PI4P et sont en fait des échangeurs PS/PI4P qui utilisent un gradient de PI4P à l'interface RE/membrane plasmique pour transporter du PS. Notre objectif actuel est de décrypter les nombreuses facettes de ce mécanisme d'échange et d'évaluer son importance dans l'homéostasie du PS et certaines fonctions cellulaires. Ce projet repose sur l’utilisation de mesures de florescence en temps réel pour quantifier l'activité des protéines in vitro, des tests de liaison membrane-protéine, la biologie des levures en collaboration avec A. Copic dans l’équipe de CL Jackson à l'IJM (Paris), la bioinformatique et l'analyse structurale.
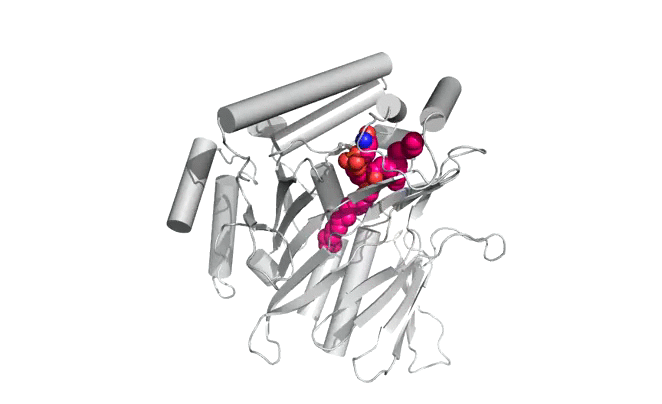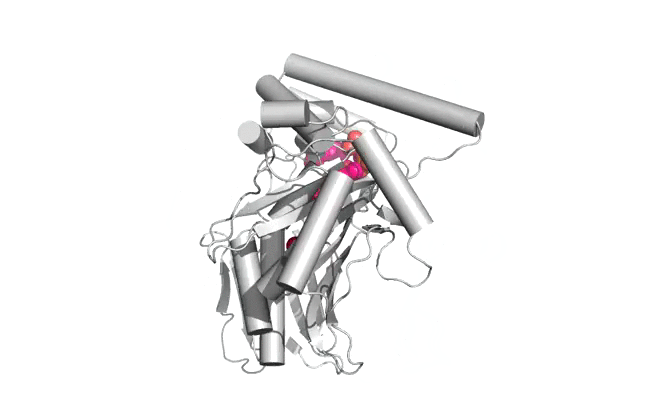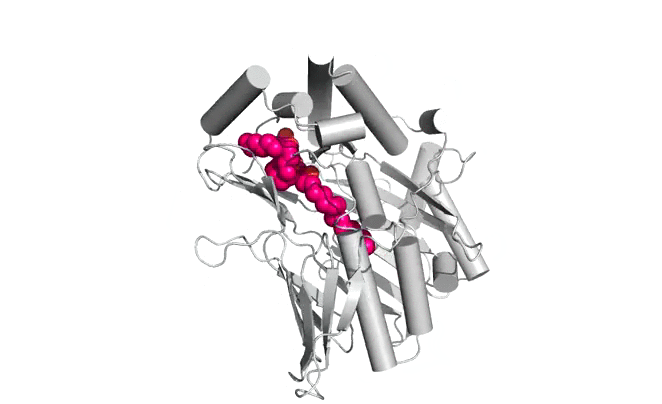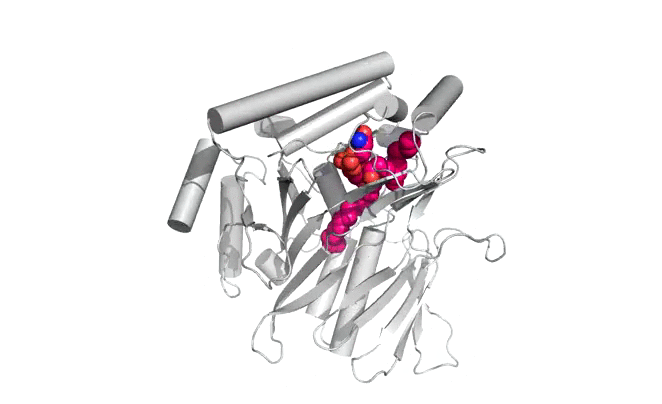 | 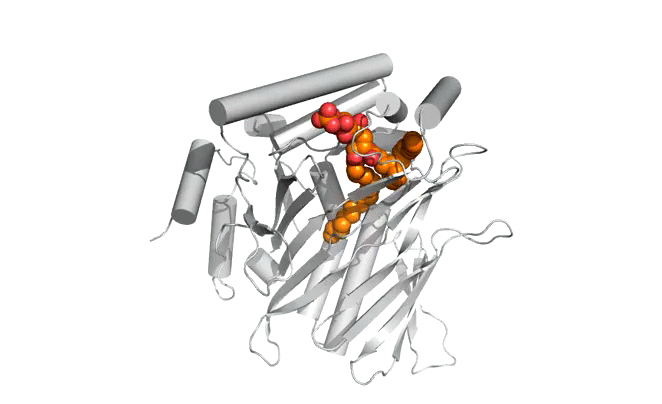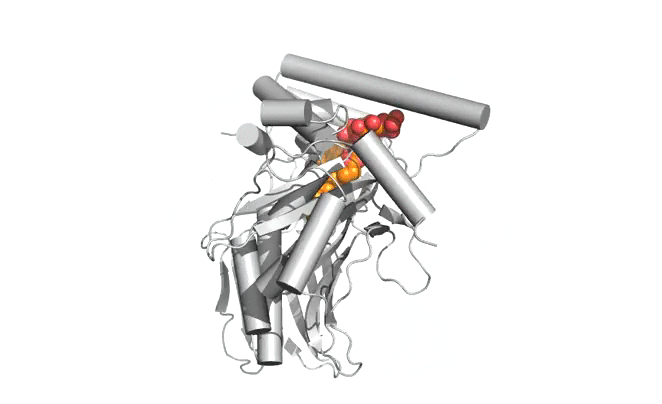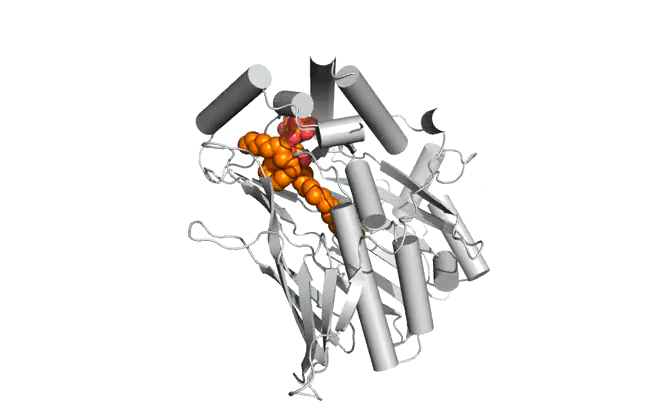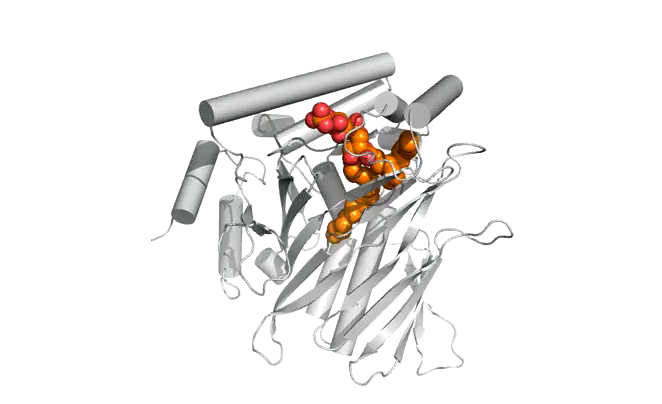 |
Structure d'Osh6p en complexe avec une molécule de PS (gauche) ou une molécule de PI4P (droite)
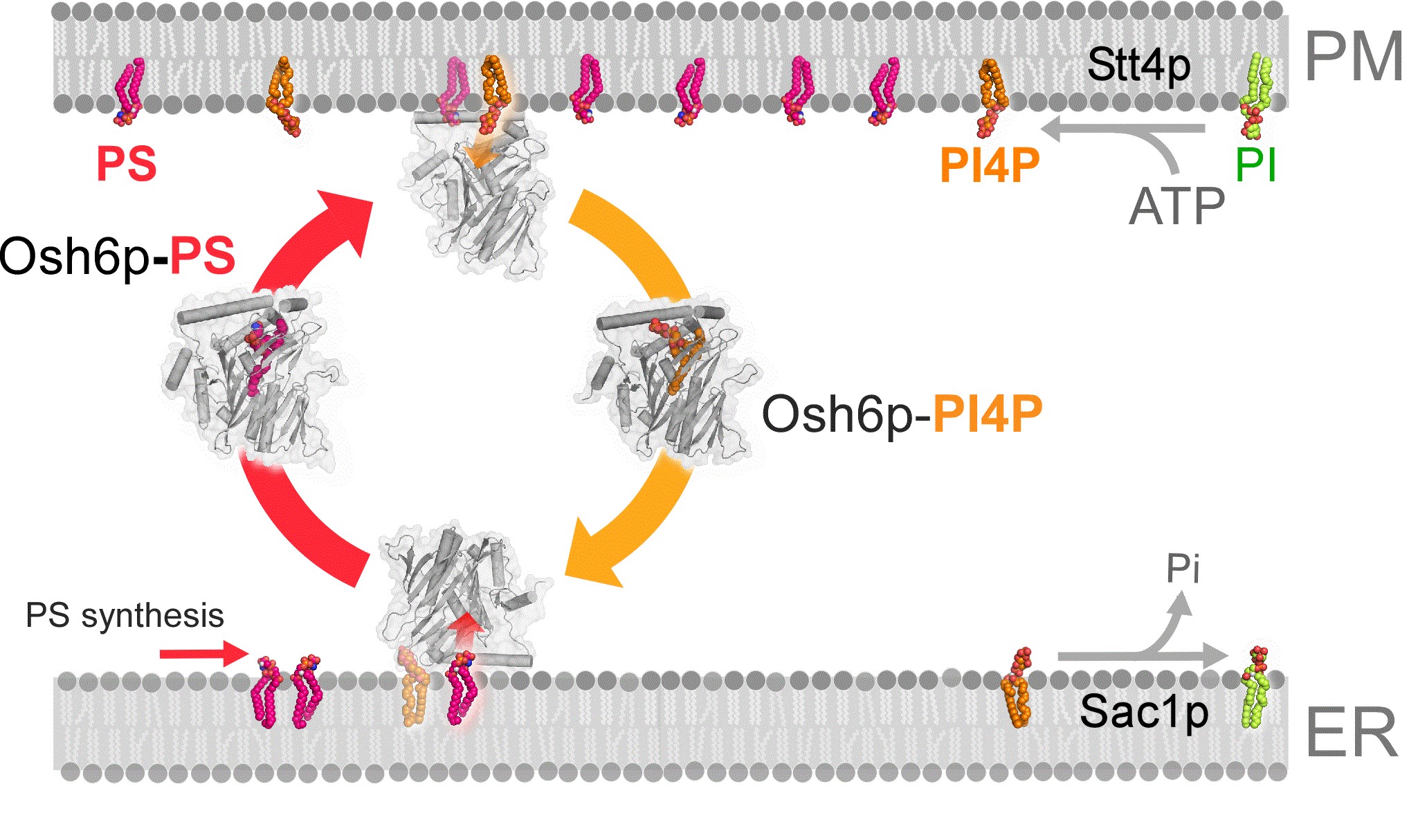 | Osh6p utilise un gradient de PI4P à l'interface RE/membrane plasmique pour transporter la PS de manière vectorielle par échange PS/PI4P, favorisant ainsi l'accumulation de PS dans la membrane plasmique.
|
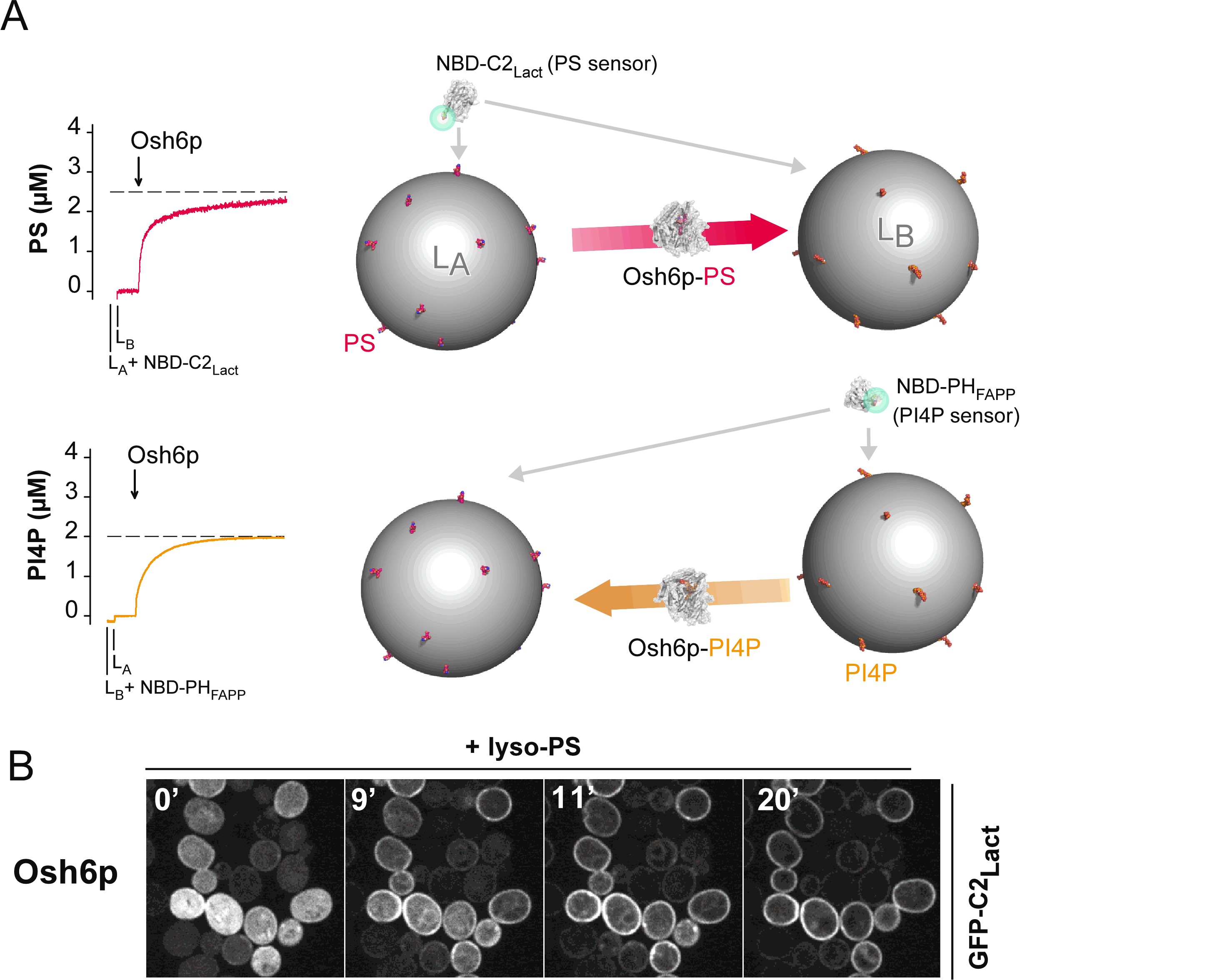 | (A) Nous avons conçu des protocoles pour mesurer en temps réel par fluorescence le transport de PS et de PI4P par la protéine Osh6p recombinante le long de direction opposée entre vésicules lipidiques artificielles (liposomes) in vitro
(B) L'activité de transport de PS par Osh6p peut également être mesurée en levure (coll. A. Copic, Paris)
|
2 - Conception de nouvelles molécules antivirales pour cibler l'OSBP. OSBP est une protéine ORP/Osh multidomaine humaine capable de fixer simultanément les membranes du RE et de l’appareil de Golgi et de créer ainsi des jonctions où elle sert d'échangeur stérol/PI4P. OSBP joue un rôle pivot dans la réplication de diverses souches virales comme celle de l’hépatite C. En effet, la multiplication de ces virus dépend d'un remodelage de certaines membranes internes en organelles de réplication qui est initié par une surproduction de PI4P. OSBP délivre massivement des stérols dans les membranes où le PI4P est surproduit, par échange stérol/PI4P, favorisant ainsi la transformation de ces membranes en sites de réplication. Des molécules appelées Orphilines ont une action antivirale car elles bloquent l'activité d'échange d'OSBP. L'objectif est de concevoir une nouvelle génération de molécules brevetables contre OSBP en utilisant des approches de criblage in silico, des analyses de liaison et de structure, en collaboration avec le groupe de W. Bourguet (CBS, Montpellier).
3 - Fonction de STARD3 dans le cancer du sein.
STARD3 est un LTP complexe comprenant un domaine MENTAL ancré dans la membrane des endosomes tardifs, un motif FFAT pour interagir avec les protéines VAPs qui résident dans le RE et un domaine START ayant une capacité de liaison aux stérols. Nos approches de reconstitution in vitro ont montré récemment que la capacité de STARD3 à relier deux membranes distinctes lui est nécessaire pour transporter du stérol efficacement entre ces membranes. Ceci corrobore les résultats obtenus par le groupe de C. Tomassetto (IGBMC, Illkirch) démontrant que STARD3 doit créer des sites de contact RE/endosome pour rediriger efficacement les stérols du RE vers les endosome au détriment de la membrane plasmique.
Une tâche importante consiste maintenant à comprendre comment STARD3 est régulé et à décrypter le rôle du domaine MENTAL en utilisant de nouvelles approches à la croisée de la biologie cellulaire et de la biochimie de reconstitution. Cela pourrait nous aider à découvrir pourquoi STARD3 joue un rôle si important dans la prolifération des cellules qui surexpriment HER2 (récepteur 2 du facteur de croissance épidermique humain) et qui sont impliquées dans l'initiation, la progression et la métastase de certains cancers, notamment le cancer du sein.
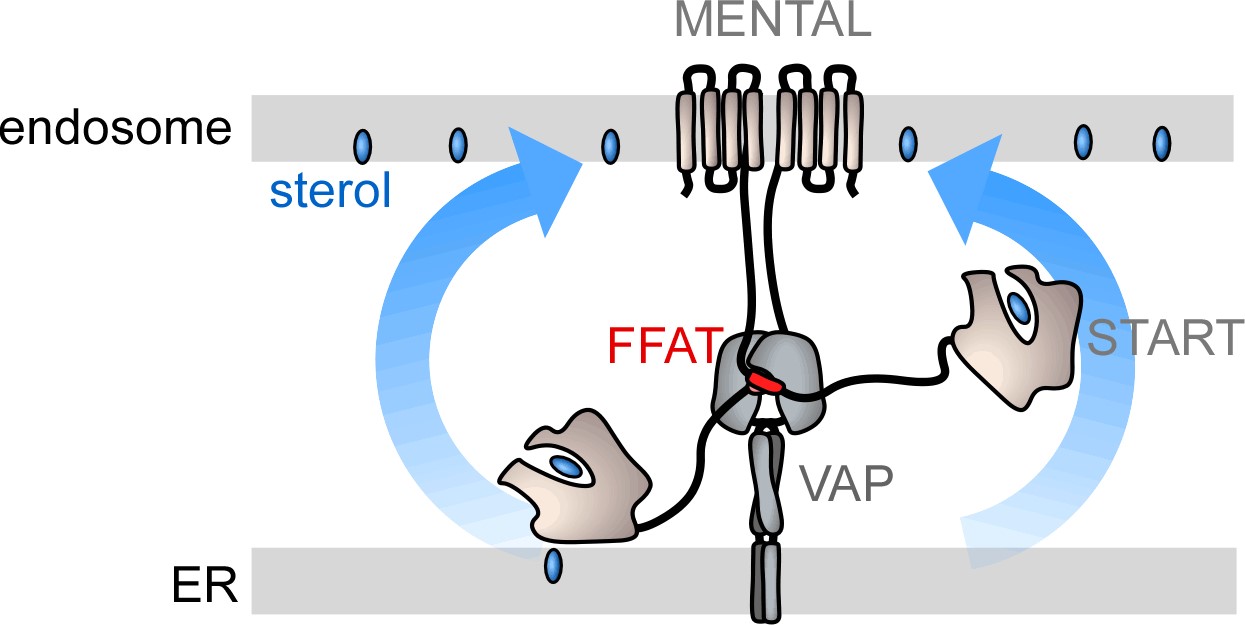 | Nous visons à mieux comprendre comment STARD3 est régulé et quel est le rôle du domaine MENTAL dans le transport des stérols. |
Financements